
Una respuesta nociva y no intencionada a un medicamento. Así describe la Agencia Española de Medicamentos y Productos Sanitarios (Aemps) un efecto adverso a un fármaco. Se trata de un evento del que se notifican cerca de 40.000 al año en España y la coordinación para registrar estas sospechas cuanto antes es fundamental. Un viaje de ida y vuelta que empieza y termina en el profesional sanitario y en la sociedad.
Por este motivo, la agencia que lidera María Jesús Lamas cuenta con un programa de notificación espontánea, dentro del Sistema Español de Farmacología de Medicamentos de Uso Humano (SEFV-H). Este método de farmacovigilancia está basado en la comunicación, recogida, registro y evaluación de notificaciones de sospechas de reacciones adversas a los medicamentos. Todas las comunidades autónomas participan en él a través de la base de Farmacovigilancia Española de Datos de Reacciones Adversas (Fedra), cuya última novedad es la integración de pasarelas informáticas para agilizar este proceso.
"Permiten que, desde los sistemas de Atención Primaria, hospitales o incluso oficinas de farmacia, se puedan notificar directamente casos de sospechas de RAM a Fedra facilitando y simplificando la notificación por profesionales sanitarios", señalan fuentes de SEFV-H a Gaceta de Salud.
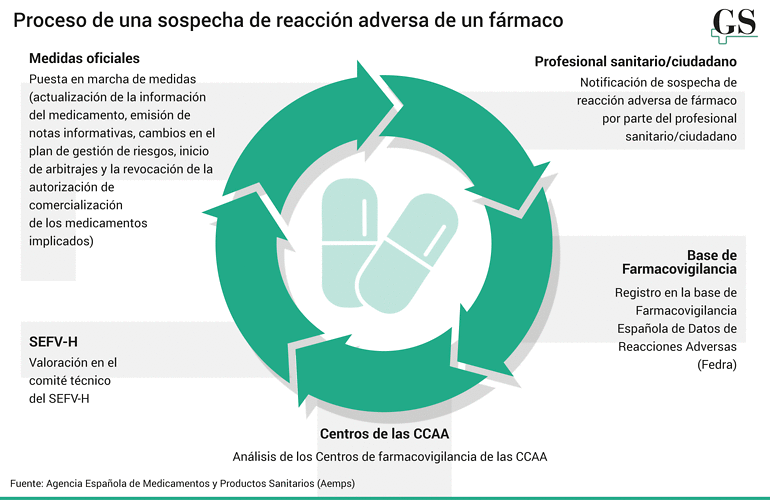
En cuanto a quién notifica al sistema la sospecha, el podio lo componen los médicos, los farmacéuticos y las enfermeras. Son el primer eslabón de esta cadena. La importancia de informar sobre estas reacciones puede desembocar en la creación de una nueva señal, según denominan desde farmacovigilancia, que llega incluso a niveles europeos. Ya que una vez que se ha enviado la posible sospecha, los centros autonómicos de farmacovigilancia (CAFV) son los que analizan la información recogida en la base de datos Fedra para detectar posibles riesgos no conocidos anteriormente o cambios en la gravedad o frecuencia de riesgos ya conocidos. Tras esta primera revisión, hay un 'cónclave', el Comité Técnico del SEFV-H, formado por técnicos de todas las comunidades autónomas, así como la propia Aemps, analizan las notificaciones.
En el caso de que estén involucrados medicamentos autorizados en algún otro país de la Unión Europea (UE), la evaluación de las señales de farmacovigilancia se realiza en coordinación con toda la red de agencias europeas. Los últimos datos ofrecidos por la agencia detallan que el año pasado se notificaron 37.944 sospechas. "En 2024, los datos indican una estabilización, volviendo a cifras comparables a las del periodo prepandémico. Esto permite interpretar mejor la tendencia real de la notificación espontánea en España", aseguran.
Gastrointestinales y dermatológicas, notificaciones más frecuentes
Los datos de la Aemps muestran que hay cuatro áreas que aglutinan el 41% de las notificaciones y son: gastrointestinales (4.312 notificaciones); dermatológicas (3.990), sistema nervioso (3.635) y trastornos generales (3.570). La identificación de riesgos es el primer paso de los procesos que engloba la farmacovigilancia, siendo por ello una actividad clave. "El análisis de las notificaciones de sospechas de reacciones adversas por parte del personal técnico del SEFV-H ha originado numerosas señales de farmacovigilancia y ha amplificado otras ya detectadas que estaban en evaluación. Notificar una sospecha de reacción adversa es un acto de responsabilidad y generosidad, ya que contribuye directamente a mejorar la seguridad de los medicamentos y proteger la salud pública", detallan desde la agencia.
El resultado de ello es la actualización de la información del medicamento, la emisión de notas informativas, los cambios en el plan de gestión de riesgos e incluso al inicio de arbitrajes y la revocación de la autorización de comercialización de los medicamentos implicados.
"Los ciudadanos y profesionales sanitarios son el eje fundamental sobre el que se construye la farmacovigilancia porque inicia y finaliza en ellos. Se inicia con la notificación de las sospechas de RAM, las cuales ayudan a la identificación de nuevos riesgos, y al mismo tiempo son los receptores finales de las comunicaciones y acciones para minimizar los riesgos evaluados, a través fundamentalmente de la ficha técnica y el prospecto", reflexionan.
Relacionados
- Solo un 10% de los tumores de pulmón se identifican en estadios precoces
- Pedro, la alpaca chilena clave para combatir potenciales "pandémicos" como el virus Hendra y Nipah
- Un verano más de consultas médicas y hospitales a medio gas
- Cantabria regula por primera vez los 'neuroderechos' con una ley pionera de salud digital
Los contenidos publicados en Gaceta de Salud han sido elaborados con afirmaciones, datos y declaraciones procedentes de instituciones oficiales y profesionales sanitarios recogidas por un grupo de periodistas especializados en el sector. Recomendamos al lector consultar cualquier duda relacionada con la salud ante un profesional del ámbito sanitario.
